Etila ftalato
| Etila ftalato | |||
 | |||
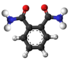
| Plata kemia strukturo de la etila ftalato | |||
 | |||
| Tridimensia kemia strukturo de la etila ftalato | |||
| Alternativa(j) nomo(j) | |||
| |||
| Kemia formulo | |||
| CAS-numero-kodo | 84-66-2 | ||
| ChemSpider kodo | 13837303 | ||
| PubChem-kodo | 6781 | ||
| Fizikaj proprecoj | |||
| Aspekto | senkolora likvaĵo kun milde aromata odoro kun amara kaj malagrabla gusto | ||
| Molmaso | 222,24 g·mol−1 | ||
| Denseco | 1,118g cm−3 | ||
| Fandpunkto | 4 °C | ||
| Bolpunkto | 295 °C | ||
| Refrakta indico | 1,5030[1] | ||
| Ekflama temperaturo | 156 °C[2] | ||
| Solvebleco | Akvo:1,080 g/L | ||
| Mortiga dozo (LD50) | 8600 mg/kg (buŝe) | ||
| Sekurecaj Indikoj | |||
| Riskoj | R20/21/22 R36/37/38 R39/23/24/25 R23/24/25 R11 R52 | ||
| Sekureco | S24/25 S45 S36/37 S16 S7 | ||
| Pridanĝeraj indikoj | |||
| Danĝero
| |||
| GHS Damaĝo Piktogramo |
| ||
| GHS Signalvorto | Averto | ||
| GHS Deklaroj pri damaĝoj | H225, H301, H311, H331, H370 | ||
| GHS Deklaroj pri antaŭgardoj | P210, P260, P280, P301, P310, P311 | ||
(25 °C kaj 100 kPa) | |||
Etila ftalato aŭ C12H14O4 estas kemia kombinaĵo, apartenanta al la funkcia grupo de la esteroj de la ftalata acido kaj etanolo. Etila ftalato estas senkolora likvaĵo kun milde aromata odoro kun amara kaj malagrabla gusto, uzata kiel gustigagento kaj odorigagento en la nutrondustrio kaj en la fabrikado de kosmetikaĵoj kaj farmaciaĵoj. Kutime ĝi estiĝas per kondensiĝa reakcio aŭ per esterigo de Fischer-Speyer kun sulfata acido kiel katalizilo. Etila ftalato estas malmulte solvebla en akvo, sed tute solvebla en alkoholo, duetila etero, kloroformo kaj plejmulto el la organikaj solvantoj. Etila ftalato reakcias kun fortaj oksidigagentoj kaj fortaj bazoj. Kiam elmetita al varmo, duetila ftalato malkomponiĝas kaj ellasas penetrantajn kaj iritajn fumojn.
Sintezoj[redakti | redakti fonton]
Sintezo 1[redakti | redakti fonton]
- Preparado per agado de ftalata acido kaj etila alkoholo:
Sintezo 2[redakti | redakti fonton]
- Preparado per traktado de ftalata anhidrido kaj etila alkoholo:
Sintezo 3[redakti | redakti fonton]
- Preparado per reakcio de etila klorido kaj ftalata acido:
Sintezo 4[redakti | redakti fonton]
- Preparado per interagado de etila klorido kaj natria ftalato:
Sintezo 5[redakti | redakti fonton]
- Preparado per transesterigo inter etila fenilacetato kaj metila ftalato:
Sintezo 6[redakti | redakti fonton]
- Preparado per acida transesterigo inter etila cinamato kaj ftalata acido:
Sintezo 7[redakti | redakti fonton]
- Preparado per alkohola transesterigo inter metila ftalato kaj etila alkoholo:
Reakcioj[redakti | redakti fonton]
Reakcio 1[redakti | redakti fonton]
- Hidrolizo de la etila ftalato:
Reakcio 2[redakti | redakti fonton]
- Sapigo de la etila ftalato:
Reakcio 3[redakti | redakti fonton]
- Reakcio per acida transesterigo kun formiata acido:
Reakcio 4[redakti | redakti fonton]
- Reakcio per alkohola transesterigo kun etila alkoholo:
Reakcio 5[redakti | redakti fonton]
- Reduktigo de la etila ftalato:
Reakcio 6[redakti | redakti fonton]
- Reakcio kun NH3:
Reakcio 7[redakti | redakti fonton]
- Reakcio kun HCl:
Vidu ankaŭ[redakti | redakti fonton]
Literaturo[redakti | redakti fonton]
- Agency for Toxic Substances & Disease Registry
- World Health Organization
- Making Diethyl Phthalate
- Ventós
- Analytical Artifacts: GC, MS, HPLC, TLC and PC
- Groundwater Chemicals Desk Reference
- Hazardous Chemicals: Safety Management and Global Regulations
- Cooper's Toxic Exposures Desk Reference







![{\displaystyle {\mathsf {{\xrightarrow[{\,}]{}}\,}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/3a133815724e6bf6cfb39eb43f1e6c1d96ea8d17)



![{\displaystyle {\mathsf {{\xrightarrow[{\,}]{2[H]}}\,}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/3e0bf23d773dd68c0756bf7219ac82b7a51e73c6)